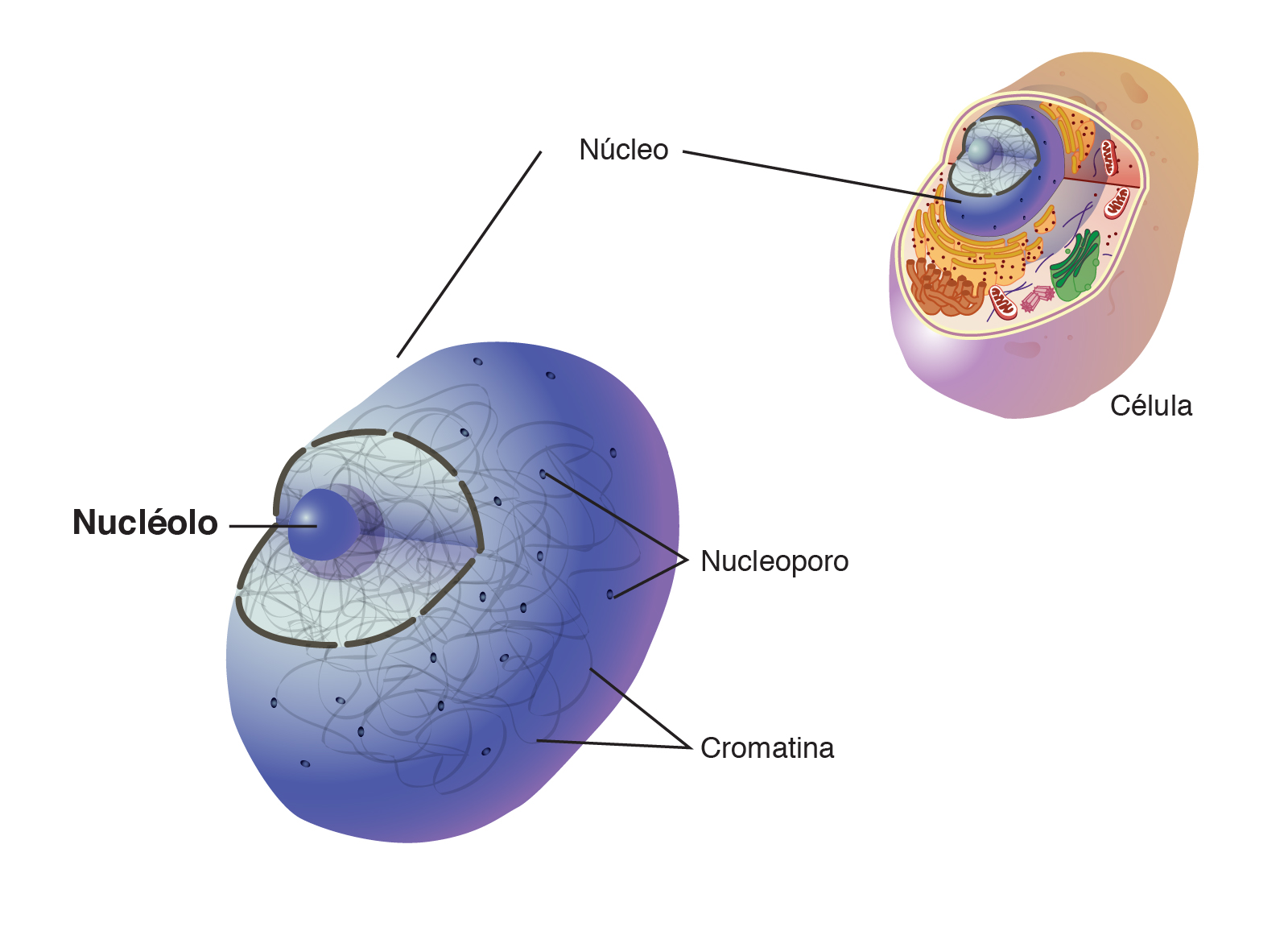
 El nucleolo es una estructura que se encuentra en el núcleo de la célula y fue visto por primera vez en 1830. En los años ´60, se descubrió que su principal función era ser el lugar donde se ensamblan los ribosomas, que a su vez son los encargados de la síntesis de proteínas.
El nucleolo es una estructura que se encuentra en el núcleo de la célula y fue visto por primera vez en 1830. En los años ´60, se descubrió que su principal función era ser el lugar donde se ensamblan los ribosomas, que a su vez son los encargados de la síntesis de proteínas. Cuando las células están bajo estrés, las proteínas tienden a plegarse y agregarse. Para evitar que se aglomeren, algunas de ellas se almacenan temporalmente en el nucleolo. Este orgánulo cuenta con unas condiciones biofísicas especiales que previenen la dañina agregación de las proteínas, otorgándole una función de protección y control de calidad de las proteínas.
 Este es el fruto de la investigación llevada a cabo por Ralf Jungmann, profesor de Física Experimental en LMU y líder del Grupo de Imagen Molecular y Bionanotecnología en el Instituto Max Planck (MPI) para Bioquímica, en cooperación con F.-Urich Hartl y Mark Hipp.
Este es el fruto de la investigación llevada a cabo por Ralf Jungmann, profesor de Física Experimental en LMU y líder del Grupo de Imagen Molecular y Bionanotecnología en el Instituto Max Planck (MPI) para Bioquímica, en cooperación con F.-Urich Hartl y Mark Hipp.El equipo de F.-Urich Hartl es pionero de la investigación en chaperonas y ya había descubierto que las chaperonas son cruciales para el correcto plegamiento de las proteínas y juegan un papel central en el control de calidad de proteínas.
Estuvieron usando la enzima luciferasa como un modelo de proteína durante muchos años para investigar los mecanismos de plegamiento de las proteínas. Al fusionar la enzima con una proteína fluorescente, los científicos pueden rastrearla bajo el microscopio y observar si la proteína está correctamente plegada o mal plagada si forma agregados.
Pudieron demostrar que la proteína luciferasa mal plegada se comportaba de manera diferente dentro del nucleolo, debido a que las proteínas mal plegadas se mantuvieron en un estado similar al líquido en lugar de agregarse, esto es posible debido a las condiciones biofísicas específicas que prevalecen dentro del orgánulo.
Las proteínas que generalmente tienden a agregarse se almacenan en una forma menos peligrosa durante el estrés, lo que protege a la célula del daño. Una vez que la célula ha tenido tiempo de recuperarse, las proteínas pueden replegarse y liberarse desde el nucleolo, en este punto, las células tienen la capacidad de activar otros mecanismos que permiten que la proteína sea reparada o degradada.
Los investigadores también demostraron que este mecanismo de protección falla si el estrés celular dura demasiado. El mantenimiento de esta integridad es fundamental para inhibir el desarrollo de la enfermedad y retrasar el proceso.
Fuente: CIENCIABIOLOGÍA, SCIENCE
Comentarios
Publicar un comentario
Gracias por comentar. Te rogamos que seas preciso y educado en tus comentarios.