 El grupo de Problemas Inversos, Optimización y Aprendizaje Automático de la Universidad de Oviedo, dirigido por el profesor Juan Luis Fernández-Martínez, en colaboración con el profesor Andrzej Kloczkowski del Batelle Center of Mathematical Medicine, trabajador del Nationwide Children Hospital de Columbus (Ohio), ha conseguido desarrollar un algoritmo el cuál permite averiguar si una mutación en la cadena de aminoácidos de una proteína puede desestabilizar la cadena y causar diferentes enfermedades, superando la fiabilidad de los métodos ya existentes.
El grupo de Problemas Inversos, Optimización y Aprendizaje Automático de la Universidad de Oviedo, dirigido por el profesor Juan Luis Fernández-Martínez, en colaboración con el profesor Andrzej Kloczkowski del Batelle Center of Mathematical Medicine, trabajador del Nationwide Children Hospital de Columbus (Ohio), ha conseguido desarrollar un algoritmo el cuál permite averiguar si una mutación en la cadena de aminoácidos de una proteína puede desestabilizar la cadena y causar diferentes enfermedades, superando la fiabilidad de los métodos ya existentes.El descubrimiento de cómo de estable es dicho cambio (polimorfismo) resulta clave para diseñar fármacos y estudiar numerosas enfermedades. Este trabajo forma parte de la tesis doctoral de Óscar Álvarez, que se desarrolla en el Departamento de Química Física y Analítica de la Universidad de Oviedo. Los resultados se han publicado en la revista 'Biomolecules'.
Las proteínas o prótidos son macromoléculas formadas por cadenas lineales de aminoácidos. Éstas se ensamblan de diversas formas, lo que les permite participar como los principales componentes estructurales de las células y los tejidos, por este motivo el crecimiento, la reparación y el mantenimiento del organismo dependen de ellas. También resultan una pieza clave en el funcionamiento del organismo de los seres vivos. Con un reducido número de aminoácidos (sólo 20 diferentes) se pueden producir millones de proteínas, siendo su secuencia la que determina su estructura y sus funcionalidades.

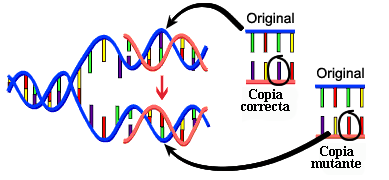
Las proteínas pueden sintetizarse según cómo están regulados los genes que las codifican. Entender cómo las mutaciones pueden llegar a afectar a las funcionalidades de una proteína es uno de los grandes dilemas en la genómica, debido a que una sustitución en la cadena de aminoácidos puede generar efectos muy diversos. El desarrollo de muchas de las enfermedades depende de si dichas mutaciones desestabilizan a las proteínas, que pueden cambiar su estructura espacial.
Tener la capacidad de predecir dicho cambio es un aspecto fundamental en el estudio de muchas enfermedades y en la búsqueda y desarrollo de diversos fármacos que permitan evitar dicho efecto. El estudio de enfermedades necesita conocer principalmente cómo impactan en la estabilidad de las proteínas que dichos genes codifican.
Para esto se han utilizado técnicas de aprendizaje automático. «Asumimos que las diferentes mutaciones tienen una curva característica de variaciones de energía. Estas curvas son aprendidas de diferentes bases de datos experimentales y son utilizadas posteriormente para predecir el efecto de nuevas mutaciones en una o varias posiciones. Según vayamos mejorando la base de datos del efecto de las mutaciones, el método diseñado aumentará su fiabilidad», afirma el profesor Fernández-Martínez.
Hace tiempo este mismo grupo consiguió desarrollar un modelo para explicar cómo las principales mutaciones en enfermos con leucemia linfocítica crónica impactaban el transcriptoma, afectando a genes, los cuales se encargan de regular el sistema inmune.
 Tanto el profesor Fernández-Martínez y Óscar Álvarez han explicado que las técnicas que han utilizado en esta investigación «se basan en la utilización del consenso, es decir, se entrenan diferentes modelos de aprendizaje automático en paralelo, de tal forma que, al validar el método con datos independientes, no solo se obtiene el grado de desestabilización, sino que también es posible cuantificar la incertidumbre del mismo, utilizando un algoritmo de decisión por voto mayoritario. Estos métodos serán utilizados en el diseño óptimo de fármacos que se acoplarán a la proteína inhibiéndola«. Este proyecto surgió en 2013 durante una visita del profesor Fernández-Martínez al centro Battelle de modelización matemática en medicina del hospital de Ohio, con el que el Grupo de Problemas Inversos de la Universidad de Oviedo posee una colaboración activa.
Tanto el profesor Fernández-Martínez y Óscar Álvarez han explicado que las técnicas que han utilizado en esta investigación «se basan en la utilización del consenso, es decir, se entrenan diferentes modelos de aprendizaje automático en paralelo, de tal forma que, al validar el método con datos independientes, no solo se obtiene el grado de desestabilización, sino que también es posible cuantificar la incertidumbre del mismo, utilizando un algoritmo de decisión por voto mayoritario. Estos métodos serán utilizados en el diseño óptimo de fármacos que se acoplarán a la proteína inhibiéndola«. Este proyecto surgió en 2013 durante una visita del profesor Fernández-Martínez al centro Battelle de modelización matemática en medicina del hospital de Ohio, con el que el Grupo de Problemas Inversos de la Universidad de Oviedo posee una colaboración activa.Para el investigador, «la estructura de investigación bio-sanitaria en los hospitales de Estados Unidos es un modelo: ingenieros, físicos, matemáticos, biólogos, bioquímicos y médicos trabajando conjuntamente contra las enfermedades a nivel traslacional, es decir, produciendo resultados en el ordenador y en el laboratorio y llevándolos al hospital. Estamos a años luz, pero esta organización también se adoptará aquí, o el sistema de salud quedará desfasado», concluye.
Fuente: El Comercio, La Nueva España
Comentarios
Publicar un comentario
Gracias por comentar. Te rogamos que seas preciso y educado en tus comentarios.