BASE MOLECULAR DE LA VIDA

 Actualmente se consideran como tales a los polihidroxialdehídos y polihidroxicetonas, sus derivados simples (aminas, ácidos, formas desoxigenadas, etc) y los productos que forman entre sí o con otros mediante enlaces.
Actualmente se consideran como tales a los polihidroxialdehídos y polihidroxicetonas, sus derivados simples (aminas, ácidos, formas desoxigenadas, etc) y los productos que forman entre sí o con otros mediante enlaces.
 Entre las cetopentosas destaca la ribulosa y la xilulosa que participan en la fotosíntesis.
Entre las cetopentosas destaca la ribulosa y la xilulosa que participan en la fotosíntesis.


Los seres vivos son químicamente son muy similares y uniformes. Casi todos ellos están formados básicamente por 25 elementos y 6 de ellos constituyen el 95% de la materia orgánica.
Elementos biogénicos o bioelementos: unos 70. Forman biomoléculas o principios inmediatos. Según su abundancia, se clasifican en:
- Mayoritarios: pueden ser primarios: 6 (C, H, O, N, S, P) o s ecundarios: 5. En menor proporción pero vitales en la fisiología celular. Mg, Ca, K, Na y Cl.
- Oligoelementos: pueden ser esenciales: son 14: Fe, Mn, Cu, Zn, Co, F, I, B, Si, V, Cr, Se, Mo, Sn y no esenciales: Unos 45. Li, Al, As, W, Ni…
- Biomoléculas: sustancias de los seres vivos formadas por combinación de bioelementos. Pueden ser:Inorgánicas: también se hallan en la materia inerte. Agua, sales minerales, gases (O2, CO2, N2…) y orgánicas: Glúcidos, lípidos, proteínas y ácidos nucleicos.
1.- BIOMOLÉCULAS INORGÁNICAS
1.1.-EL AGUA

- Es el llamado “líquido de la vida”: entre un 65% y un 95% de la mayoría de seres vivos es agua.
- Está formada por dos átomos de hidrógeno y uno de oxígeno. Los orbitales del O forman un tetraedro. Debido a ello, el ángulo entre H y O es de 104,5º.
- Es una molécula neutra pero polar, con distribución asimétrica de los electrones. Los e- se concentran junto al O, dándole densidad de carga negativa (δ-), y se alejan de los H, que muestran carga positiva (δ+). La molécula de agua es un dipolo.
- Enlaces de H: son muy débiles e inestables, hacen que el agua tenga una estructura reticular muy estable.
PROPIEDADES Y FUNCIONES BIOLÓGICAS DEL AGUA
- Gran calor específico: almacenar gran cantidad de energía sin aumentar temperatura, debido a que hay que romper puentes de H.
- Acción disolvente: gracias a los puentes de H. Según la solubilidad en agua se distinguen: sustancias hidrofílicas, hidrofóbicas y anfipáticas.
- El agua puede dar lugar a tres tipos de disoluciones: Moleculares: los solutos son moléculas orgánicas pequeñas, iónicas: los solutos son electrolitos y coloidales: los solutos son macromoléculas
- Funciones: metabolismo (es el medio donde se dan la mayoría de las reacciones químicas, transporte de nutrientes y desechos (detoxificación).
- Elevada fuerza de cohesión: mantiene a las moléculas de agua unidas entre sí por los puentes de H. Esto hace que el agua sea incompresible
- Funciones: esqueleto hidrostático (gusanos y otros invertebrados), turgencia (en células vegetales), tensión superficial (gotas de agua).
- Elevada fuerza de adhesión: permite que las moléculas de agua puedan adherirse a otras moléculas, así como a determinadas superficies, mediante puentes de H.
- Funciones: capilaridad (transporte de savia bruta en vegetales).
- Funciones: tampón térmico, homeotermia.
- Elevado calor latente de evaporación: el agua absorbe mucha energía (para romper puentes de).
- Función: refrigeración por transpiración
- Menor densidad del hielo: máxima densidad a los 4 ºC. El hielo (0º) es menos denso y flota en el agua líquida.
- Función: supervivencia de organismos bajo aguas congeladas.
- Otras funciones: fotosíntesis (fuente de H); hidrólisis (rotura de enlaces: digestión, catabolismo
Compuestos inorgánicos en los seres vivos.
- Sales insolubles: no se disuelven en agua, precipitan y forman estructuras sólidas, por lo que suelen tener función plástica y actuar como protección y sostén:
- Caparazones de moluscos y crustáceos (carbonato cálcico (CaCO3)); caparazones silíceos de diatomeas y radiolarios (sílice).
- Esqueleto interno de vertebrados (huesos): fosfato, cloruro, fluoruro y carbonato de calcio. Fluoruro de calcio: esmalte dental.
- Paredes vegetales de plantas: sílice en las hojas de gramíneas y ‘pelos’ urticantes de ortigas.
- Acumulaciones en células vegetales: oxalato cálcico. Son desechos vegetales, muy abundantes en espinacas, grelos, etc. Pueden provocar cálculos renales y biliares.
- Otolitos: cristales de carbonato cálcico en el oído de vertebrados para el equilibrio.
- Magnetita: en algunos animales, para la orientación.
- Sales solubles: se disuelven en agua y aparecen disociadas en iones, llamados electrolitos. Realizan numerosas funciones:
- Funciones catalíticas: en conjunción con otras moléculas. Cu+, Mn2+, Mg2+, Zn+,… son cofactores enzimáticos.
- Funciones osmóticas: paso del agua a través de membranas celulares: Na+, K+, Cl-, Ca2+. Participan en gradientes electroquímicos, potenciales de membrana y transmisión de impulsos nerviosos.
- Función tamponadora: mantienen el pH. Carbonato/bicarbonato (CO32-/HCO3-) y monofosfato/bifosfato (H2PO4-/HPO42-).
- Nutrientes: los organismos autótrofos utilizan las sales (NO3-, SO42-, PO43-, etc) para la síntesis de compuestos orgánicos.
1.3.- GASES
El O2 en la respiración; CO2 para la fotosíntesis y quimiosíntesis; N2 en bacterias fijadoras de N; óxido nítrico (NO) como mensajero químico, vasodilatador, etc.
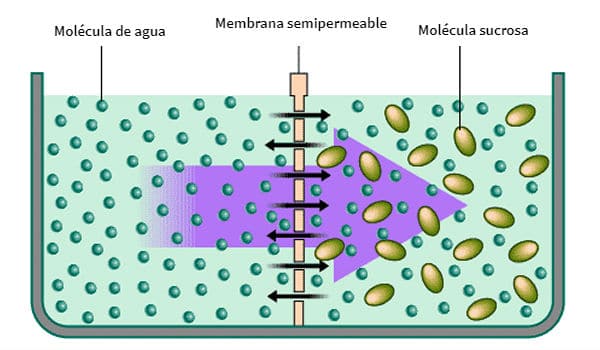
1.4.-ÓSMOSIS Y PRESIÓN OSMÓTICA
La ósmosis es el paso de agua, a través de una membrana semipermeable desde la disolución más diluida a la más concentrada.
Presión osmótica sería la presión necesaria para impedir dicho flujo.
Este proceso es importante en los seres vivos porque la membrana plasmática es semipermeable. Las células han de estar en equilibrio osmótico con su medio. Las disoluciones con igual concentración de solutos se denominan isotónicas. Una disolución es hipertónica si está más concentrada que otra (hipotónica).
El comportamiento osmótico es diferente en células animales y vegetales:

- Células animales: en medio hipotónico entra agua. Las células se hinchan (turgencia) y pueden estallar (lisis, hemólisis en eritrocitos). En medio hipertónico sale agua: deshidratación y muerte (crenación en eritrocitos).
- Células vegetales: en medio hipotónico entra agua y se produce la turgencia, pero la pared vegetal impide la lisis. En medio hipertónico sale agua, la membrana se separa de la pared y se rompe (plasmólisis), dando deshidratación y marchitez.
1.5.-DIFUSIÓN Y DIÁLISIS
- Difusión: tiene lugar cuando dos disoluciones de diferente concentración están separadas por una membrana permeable o sin membrana. En este caso se produce el paso de solutos desde la disolución hipertónica a la hipotónica.
- Diálisis: esta técnica permite separar solutos de pequeño tamaño de una disolución. Para ello se emplean membranas con poros de tamaño determinado.
BIOMOLÉCULAS ORGÁNICAS
2.1.- GLÚCIDOS

Clasificación:
- Osas o monosacáridos: Son moléculas sencillas, de 3 a 9 C. Son azúcares, es decir, dulces, solubles, cristalizables y no hidrolizables. Forman los monómeros de los demás glúcidos. A su vez, pueden ser aldosas o cetosas.
- Ósidos: Están formados por la unión de monómeros mediante enlace O-glucosídico, con pérdida de una molécula de agua. Son hidrolizables. Pueden ser:
- Holósidos: formados sólo por glúcidos.
- Oligosacáridos (2 a 10 monómeros)
- Polisacáridos (más de 10 monosacáridos). Los polisacáridos, a su vez, pueden ser homopolisacáridos o heteropolisacáridos.
- Heterósidos o glucoconjugados: formados por glúcidos y sustancias no glucídicas: glucolípidos y glucoproteínas.
2.2. OSAS O MONOSACÁRIDOS
Son polihidroxialdehídos o polihidroxicetonas de 3 a 9 átomos de C. Fórmula (CH2O)n y se nombran con el prefijo aldo- (o ceto-) + número de C + -osa: aldotriosa, cetopentosa, aldohexosa… Muchos tienen nombres comunes: glucosa, fructosa, ribosa,…La representación más sencilla se denomina proyección de Fisher, que es plana.
2.2.1. Derivados de los monosacáridos
No se ajustan a la fórmula general, ya que presentan otros grupos funcionales.
- Desoxiazúcares: tienen algún oxígeno menos, desoxirribosa (derivado de la ribosa, en el ADN) o fucosa. Forma parte de glucoproteínas y glucolípidos.
- Aminoazúcares: sustitución en hexosas del hidroxilo (-OH) de C2 por un grupo amino (-NH2). Destacan: la glucosamina y la N-acetil-glucosamina, condroitina, N-acetil-murámico
- Ácidos urónicos: proceden de la oxidación del alcohol primario de una hexosa a grupo ácido (-COOH). Destacan: ácido glucurónico y galacturónico, en gomas, mucílagos, pectinas, etc.
2.2.2. Propiedades de los monosacáridos
- Propiedades físicas: sólidos, dulces, blancos, solubles, cristalinos, con isomería espacial y óptica.
- Propiedades químicas: el grupo carbonilo les da carácter reductor, reacción de Fehling +: reducen el ión cúprico (Cu2+) a cuproso(Cu+), oxidando el carbonilo (-CO-) a carboxílico (-COOH)). Además, les permite enlaces hemiacetálicos internos, enlaces glucosídicos con otras moléculas y enlaces éster
2.2.3. Triosas
Son los monosacáridos más sencillos, con 3 átomos de C. Su fórmula molecular es C3H6O3. Existe sólo una cetotriosa, la dihidroxiacetona; y una aldotriosa, el gliceraldehído. Sin embargo, el gliceraldehído presenta un carbono asimétrico, es decir, con sus 4 valencias saturadas con radicales diferentes, debido a ello presenta isomería . Los isómeros son moléculas con la misma composición y estructura pero con diferentes propiedades.
Existen muchos tipos de isomerías, las más importantes son:I
- Isomería espacial o estereoisomería: por cada C asimétrico existen 2 disposiciones espaciales no superponibles, imágenes especulares.
- Isomería óptica: el carbono asimétrico proporciona otra propiedad a los azúcares, la de desviar la luz polarizada que atraviese una disolución de dicho azúcar. Si la luz se desvía a la derecha, el azúcar es dextrógiro o (+); si la desvía a la izquierda es levógiro o (-).
2.2.4. Tetrosas
Monosacáridos con 4 C. Fórmula general: C4H8O4. Hay dos aldotetrosas: eritrosa y treosa y una cetotetrosa, la eritrulosa. La eritrulosa sólo tiene un C asimétrico y, por tanto, 2 enantiómeros (D y L). Sin embargo, las aldosas tienen 2 C asimétricos y 4 isómeros.
2.2.5. Pentosas
Monosacáridos con 5 C. Fórmula general: C5H10O5. Las aldopentosas tienen 3 C asimétricos y, por tanto, 8 estereoisómeros, 4 D y 4 L. Las cetopentosas 2 C asimétricos, 4 estereoisómeros.
Monosacáridos con 5 C. Fórmula general: C5H10O5. Las aldopentosas tienen 3 C asimétricos y, por tanto, 8 estereoisómeros, 4 D y 4 L. Las cetopentosas 2 C asimétricos, 4 estereoisómeros.
Entre las aldopentosas destacan la ribosa y su derivado, la desoxirribosa, la arabinosa y la xilosa.

2.2.6. Hexosas
Osas de 6 C. Fórmula general: C6H12O6. Aldohexosas con 4 C asimétricos y 16 estereoisómeros, 8 D y 8 L. Las cetohexosas tienen 3 C asimétricos, 8 estereoisómeros, 4 D y 4 L.
- Ciclación mediante proyección de Fisher: Las hexosas en disolución presentan estructura ciclada en anillos de 5 o 6 átomos (furanosas y piranosas, respectivamente). La ciclación se produce entre el C1 o C2 , con el grupo hidroxilo (-OH) del penúltimo carbono de la molécula. Se forma así un enlace hemiacetálico interno, uno de los carbonos pasa a ser anomérico, que lleva un grupo hidroxilo llamado –OH hemiacetálico, el cual mantiene el carácter reductor del monosacárido.
- Ciclación mediante proyección de Haworth: El carbono anomérico da lugar a dos nuevos estereoisómeros, llamados anómeros. Si el –OH queda hacia abajo se llama anómero α y si queda hacia arriba, anómero β.
Principales hexosas
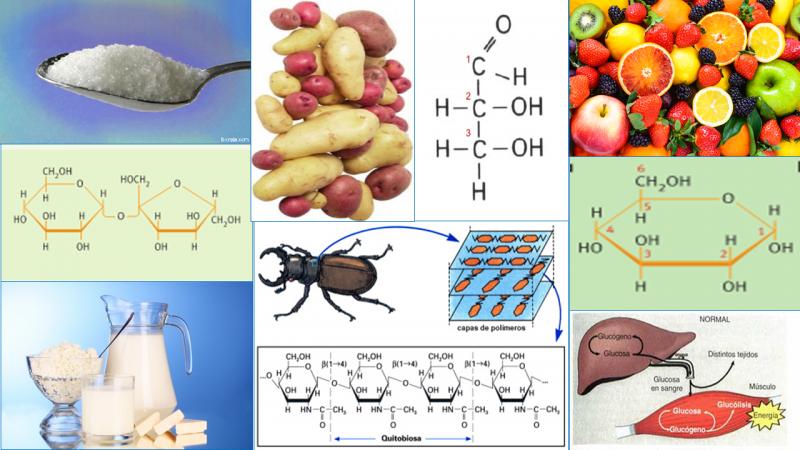
- Glucosa: es una aldosa (C6H12O6). Llamado también azúcar de uva y dextrosa (+). Abundante en vegetales ). En plantas puede hallarse libre o polimerizada, bien como reserva (almidón) o estructural (celulosa). Es el principal combustible celular. En animales se halla libre (en la sangre); o polimerizada (glucógeno en hígado y músculo estriado).
- Galactosa: aldosa (C6H12O6). No suele aparecer libre, sino como parte del disacárido lactosa. Se halla en la leche, en polisacáridos complejos y en glucolípidos y glucoproteínas (glicocálix).
- Manosa: aldosa (C6H12O6). Libre en la corteza de algunos vegetales o formando parte de polisacáridos de bacterias, algas, hongos y algunos vegetales.
- Fructosa: cetohexosa (C6H12O6). Llamada también levulosa (-). Libre en frutas, miel y semen. Forma el disacárido sacarosa y ciertos polisacáridos.
Moléculas de 2 a 10 monosacáridos. Los más importantes son los disacáridos (C12H22O11), formados por la unión de 2 monosacáridos unidos por enlace O-glucosídico. En el enlace se pierde una molécula de agua.
El enlace O-glucosídico puede ser dicarbonílico (se forma entre el –OH hemiacetálico (el del C anomérico) del primer monosacárido y el –OH hemiacetálico del otro); o monocarbonílico (entre el -OH hemiacetálico y otro –OH).
Los principales disacáridos son:
- Lactosa: azúcar de la leche. Unión del C1 de la β-D-galactosa con el C4 de la β-D-glucosa, dando β-D-galactosa (1,4) β-D-glucosa. Es un enlace monocarbonílico, sólo interviene un –OH hemiacetálico. El otro queda libre y, por tanto, tiene carácter reductor.
- Sacarosa: sucrosa, azúcar de caña o de remolacha. Unión del C1 (carbonílico) de la α-D-glucosa y el C2 (carbonílico) de la β-D-fructosa: α-D-glucosa (1,2) β-D-fructosa. Es un enlace dicarbonílico, no reductor.
- Celobiosa: procede de la hidrólisis de la celulosa. Es la β-D-glucosa (1,4) β-D-glucosa. Una glucosa está invertida respecto a la otra, lo que hace difícil hidrolizar el enlace β (1,4), por ello es indigerible por la mayoría de animales.
- Maltosa: obtenida por hidrólisis del almidón. La cebada germinada y tostada produce malta, con enzimas hidrolíticos del almidón, Es α-D-glucosa (1,4) α-D-glucosa.
- Isomaltosa: por hidrólisis de los puntos de ramificación de almidón y glucógeno. Similar a la maltosa, pero con enlaces α (1,6)
2.4.- ÓSIDOS. POLISACÁRIDOS
Son macromoléculas de monosacáridos o sus derivados unidos por enlaces O-glucosídicos. Son los glúcidos más abundantes. No son reductores, pues los –OH hemiacetálicos están ocupados en los enlaces O-glucosídicos.
2.4.1. Homopolisacáridos
Formados por la repetición de un único monosacárido.
- Celulosa: polímero lineal de β-D-glucosas unidas por enlaces β (1-4), la unidad repetida es la celobiosa. Las β-D-glucosas establecen puentes de H intracatenarios. Además, se forman puentes de H intercatenarios, por lo que se forman haces de cadenas. Como consecuencia, la celulosa tiene una estructura muy densa, lo que la hace muy insoluble, difícil de hidrolizar, casi inerte y resistente. Por ello tiene función estructural principalmente en la pared celular vegetal.
- Quitina: polímero de N- acetil-β-D-glucosamina, con enlaces β (1-4). Por ello es también lineal, insoluble y muy resistente. Se encuentra formando parte de la pared celular de hongos y el exoesqueleto de artrópodos.
- Almidón: polímero ramificado de α-D-glucosa. Se almacena en gránulos dentro de los amiloplastos.Abundante en tubérculos (patata), bulbos (cebolla), rizomas (helechos) y endospermo de semillas (cereales y legumbres). Se hidroliza mediante amilasas y maltasas. Aunque se considera un polímero de α-D-glucosa, en realidad está formado por dos polímeros diferentes: amilosa y amilopectina.
- Amilosa: polímero lineal de α-D-glucosas unidas por enlaces α (1-4) (maltosas).
- Amilopectina: polímero ramificado con cadenas helicoidales de α-D-glucosas unidas por enlaces α (1-4), pero con ramificaciones mediante enlaces α (1-6).
- Glucógeno: polímero de α-D-glucosa muy similar a la amilopectina, pero más ramificado, con una ramificación cada 8 ó 10 glucosas. Polímero de reserva en animales. Abunda en hígado y músculo estriado.2.5.2.
2.4.2.-Heteropolisacáridos
Polisacáridos formados por dos o más monosacáridos (o derivados) diferentes.
Los más importantes son:
- Hemicelulosas, pectinas, agar-agar, gomas, mucílagos… Estructura y defensa en plantas y algas.Ácido hialurónico y condroitina
- Heparina: impide la coagulación de la sangre.
2.5. GLUCOCONJUGADOS
Compuestos formados por una parte glucídica (glucano) unida covalentemente a otra lipídica (glucolípidos) o proteica (glucoproteínas). Tienen funciones de sostén y protección pero también de señalización en las membranas celulares.
3.- LÍPIDOS
Los lípidos son moléculas orgánicas formadas por C, O, H y, algunos, con S y P. Son muy insolubles en agua pero solubles en disolventes orgánicos. Clasificación: existen diferentes criterios de clasificación. Según su estructura molecular pueden ser:
3.- LÍPIDOS
Los lípidos son moléculas orgánicas formadas por C, O, H y, algunos, con S y P. Son muy insolubles en agua pero solubles en disolventes orgánicos. Clasificación: existen diferentes criterios de clasificación. Según su estructura molecular pueden ser:

- Saponificables: presentan enlaces éster (-COO-), por lo que forman jabones al reaccionar con bases alcalinas (NaOH, KOH). Son los ácidos grasos y sus derivados mediante enlaces éster u otras modificaciones.
- Insaponificables: carecen de enlace éster, por lo que no pueden formar jabones. La mayoría derivan del isopreno, por lo que se llaman en general isoprenoides (terpenos y esteroides). Otros se forman por oxidación de ácidos grasos (eicosanoides).
3.1.- ÁCIDOS GRASOS
Son ácidos orgánicos con un grupo carboxilo unido a una larga cadena alifática.
Son importantes combustibles celulares, que pueden hallarse libres (plasma, citoplasma), pero suelen estar unidos mediante enlace éster a otras moléculas. Se diferencian entre sí por la longitud de la cadena alifática y por el grado de saturación, pueden ser;
- Ácidos grasos saturados: sin dobles enlaces. Destacan el palmítico (16 C) y el esteárico (18 C).
- Ácidos grasos insaturados: con un enlae (monoinsaturados) o varios (poliinsaturados) dobles enlaces. Destacan el oleico: octadecenoico y el linoleico: octadecadienoico
- Ácidos grasos esenciales: los ácidos poliinsaturados se denominan esenciales porque no se pueden sintetizar y han de tomarse con la dieta. Son precursores de moléculas reguladoras similares a las hormonas. Se denominan también omega-3 (α-linolénico) y omega-6, por el lugar donde tienen sus dobles enlaces.
Propiedades físicas de los ácidos grasos:
- Son moléculas anfipáticas, con una zona apolar, lipófila, insoluble en agua (cadena alifática) y otra polar o hidrófila, soluble en agua (grupo carboxilo).
- Los saturados presentan interacciones por puentes de H entre los grupos carboxilos y por enlaces de Van der Waals entre las cadenas alifáticas. Debido a estos enlaces, su punto de fusión es alto, Por otro lado, los insaturados, tienen curvaturas en sus cadenas por los dobles enlaces, lo que dificulta las interacciones, por lo que su punto de fusión es menor.
Propiedades químicas de los ácidos grasos:
- Las insaturaciones facilitan la rotura de las moléculas, formando aldehídos volátiles de sabor y olor a rancio.
- Son capaces de formar enlaces éster con alcoholes y otras moléculas. Cuando se hidrolizan con álcali, se forman sales de ácidos grasos, llamadas jabones. Este proceso es la saponificación.
3.2.- ACILGLICÉRIDOS
Ésteres de la glicerina o glicerol con 1 ,2 o 3 ácidos grasos. Los más importantes son los triacilglicéridos.
- Triacilglicéridos o grasas: ésteres de la glicerina o glicerol con 3 ácidos grasos saturados o insaturados, iguales o diferentes.
- Funciones de las grasas
- Reserva energética en plantas (vacuolas de frutos secos y semillas oleaginosas) y animales (adipocitos del tejido adiposo).
- Aportan más energía que los glúcidos y requieren menos agua. Además, las grasas sirven de almohadilla protectora y aislante térmico.
- Los animales tienen un tejido especial, el adiposo pardo o marrón, que proporciona calor.
- Clasificación de las grasas: se clasifican en base al punto de fusión:
- Sebos: sólidos. Grasa de ovejas, cabras, vacas… Ácidos grasos largos y saturados.
- Mantecas: semisólidas. Cerdo, humanos y otros animales.
- Aceites líquidas. Tienen ácidos grasos insaturados y/o de cadena corta. En plantas oleaginosas: frutos,semillas, algas y pescado azul.
3.3. -CERAS
Son mezclas complejas de lípidos apolares, sobre todo formados por la unión de un ácido graso de cadena larga y un alcohol también de cadena larga. Son moléculas muy apolares, sólidas e hidrófobas, por lo que tiene función protectora y estructural. Así, se hallan en:
- Glándulas sebáceas de vertebrados, cutícula de invertebrados, hojas, frutos y tallos jóvenes, cera de abeja, lanolina y espermaceti: producido por los cachalotes para su flotabilidad.
3.4.- LÍPIDOS COMPLEJOS O DE MEMBRANA
Formados por sustancias lipídicas (ácidos grasos) y no lipídicas. Forman parte de las membranas biológicas.
Son moléculas anfipáticas, con una región apolar o hidrófoba unida mediante enlace éster a un alcohol y una zona polar o hidrófila.
Hay dos tipos: glicerolípidos (con glicerina) y esfingolípidos (con esfingosina).
3.4.1.-Glicerolípidos: Molécula de glicerina unida por enlace éster a dos ácidos grasos y a otra molécula que puede ser un monosacárido o el ácido ortofosfórico.
- Gliceroglucolípidos: el tercer alcohol de la glicerina se une, mediante O-glucosídico, a un monosacárido. Se encuentran en membranas de bacterias y células vegetales.
- Glicerofosfolípidos: el tercer –OH de la glicerina se esterifica con una molécula de ácido ortofosfórico que, a su vez, forma enlace éster con un –OH de un derivado aminado o de un polialcohol. Aunque los fosfolípidos son insolubles en agua, su carácter anfipático les permite formar agregados en el agua.
- Micelas: son gotas lipídicas con los grupos polares hacia afuera, en contacto con el agua: emulsiones (mayonesa).
- Monocapas: se extienden sobre la superficie del agua, con las regiones polares en contacto con el agua.
- Bicapas: en gran concentración, los fosfolípidos forman bicapas, equivalentes a dos monocapas unidas por sus regiones hidrófobas y protegidas de la fase acuosa. Las bicapas suelen plegarse sobre sí mismas, formando liposomas,
3.4.2.- Esfingolípidos
Son derivados de la ceramida = ácido graso + esfingosina ( mediante enlace amida. Se clasifican en:
- Esfingoglucolípidos: ceramida + monosacárido mediante enlace O-glucosídico.
- Cerebrósidos: simples, con glucosa o galactosa.
- Gangliósidos: complejos, con cadenas ramificadas de oligosacáridos.
- Esfingofosfolípidos: ceramida + ácido ortofosfórico + etanolamina o colina mediante enlaces éster. Forman las esfingomielinas, abundantes en el tejido nervioso.
3.5.-TERPENOS O ISOPRENOIDES
Lípidos insaponificables derivados del isopreno. Se clasifican en:
- Monoterpenos: unión de 2 isoprenos. Esencias vegetales: mentol, alcanfor, limoneno,..
- Diterpenos: unión de 4 isoprenoides. Fitol, vitaminas liposolubles A, E y K.
- Triterpenos: 6 isoprenos. Precursores del colesterol.
- Tetraterpenos: 8 isoprenos. Pigmentos fotosintéticos carotenoides: carotenos y xantofilas.
- Politerpenos: miles de isoprenos. Caucho.
3.6.- ESTEROIDES
Derivados del ciclopentanoperhidrofenantreno o gonano, que tiene cuatro anillos carbonados unidos.
Se diferencian por los sustituyentes en el gonano y los dobles enlaces. Entre los principales están:
- Sales biliares: anfipáticas, con propiedades detergentes: emulsionan las grasas y facilitan su digestión y absorción.
- Esteroles: con un alcohol en el C3 y una cadena alifática en el 17, así como un doble enlace en el anillo B.
- Grupo vitamina D: formada a partir de provitaminas vegetales o animales y por radiación UV sobre la piel.
- Colesterol: en membranas biológicas de animales. Da resistencia y rigidez. Es el precursor de los demás esteroides.
- Hormonas esteroides: corteza suprarrenal (cortisona, aldosterona), hormonas sexuales (testosterona, estrógenos, progesterona) y ecdisonas (muda de artrópodos).
3.7.- EICOSANOIDES
Son moléculas lipídicas derivadas de la oxidación de ácidos grasos esenciales (omega 3 y 6). Todos tienen 20 C. Actúan como mediadores en el sistema nervioso, el sistema inmune y la respuesta inflamatoria.


Comentarios
Publicar un comentario
Gracias por comentar. Te rogamos que seas preciso y educado en tus comentarios.