1. Proteínas.
 Biomoléculas de elevado peso molecular formadas por combinación de unos 20 monómeros diferentes llamados aminoácidos.Son la biomoléculas más abundantes en los seres vivos, las más variadas y las de mayor número de funciones.
Biomoléculas de elevado peso molecular formadas por combinación de unos 20 monómeros diferentes llamados aminoácidos.Son la biomoléculas más abundantes en los seres vivos, las más variadas y las de mayor número de funciones.
1.1 Aminoácidos proteicos.
Existen 20 aa diferentes, los aa proteicos, están formados por un carbono central (Cα) que se une a un grupo amino (-NH2), un grupo ácido (-COOH), un hidrógeno (-H) y una cadena lateral (R) variable.
De los 20 aa, los humanos sólo sintetizan 12 en adultos y 10 en la infancia, el resto ha de tomarse con la dieta, los llamados aa esenciales.
Son anfóteros, actúan como ácidos y como bases. En disolución, el grupo amino y el ácido están ionizados, formas zwitteriónicas.
Algunos aa o derivados intervienen en la comunicación celular, como neurotransmisores o como hormonas.
Se clasifican según la polaridad de las cadenas R laterales:
-Apolares: cadena R con grupos hidrófobos que se unen a otros por fuerzas de Van der Waals. Pueden ser alifáticos u aromáticos.
-Polares sin carga: R con grupos polares que pueden formar puentes de H.
-Polares con carga ácidos: R tiene grupos carboxilo.
-Polares con carga básicos: R tiene grupos amino.
1.2. Niveles de organización de las proteínas.
La funcionalidad de las proteínas depende de su estructura tridimensional o espacial, la cual presenta cuatro niveles de organización:
-Estructura primaria: Es la formada por la secuencia de aa. Los aa se unen por enlace peptídico, unión entre el amino de un aa y el carboxilo de otro, con pérdida de H2O. Se forma así un péptido.
Toda cadena peptídica tiene un extremo amino (N-terminal) y otro carboxilo (C-terminal). La estructura primaria viene así definida por el número, tipo y secuencia de los aa.
Las cadenas peptídicas pueden rotar alrededor de los enlaces C-Cα y N-Cα, pero no alrededor del enlace peptídico, que tiene carácter de doble enlace. Por ello, los átomos del enlace peptídico están en un mismo plano y le da a la cadena un aspecto de placas planas articuladas.
-Estructura secundaria: A medida que la cadena polipeptídica se sintetiza en los ribosomas, se va plegando para adquirir la estructura tridimensional más estable. Es este plegamiento intervienen proteínas llamadas chaperonas. La estructura secundaria es la conformación espacial de la cadena polipeptídica, unida por puentes de H entre los grupos –C=O de unos enlaces peptídicos y los –NH de otros enlaces. Puede tomar una forma irregular.
 -Vitaminas: Son sustancias de naturaleza variable, imprescindibles para el metabolismo pero no sintetizables, deben tomarse en la dieta.Las vitaminas, a diferencia de los aa esenciales o los ácidos grasos esenciales, se requieren en cantidades mínimas.Su falta provoca avitaminosis o hipovitaminosis, que produce enfermedades carenciales. El exceso, sobre todo de las liposolubles, provocar hipervitaminosis, que ocasiona efectos secundarios.Las vitaminas se clasifican en liposolubles e hidrosolubles.
-Vitaminas: Son sustancias de naturaleza variable, imprescindibles para el metabolismo pero no sintetizables, deben tomarse en la dieta.Las vitaminas, a diferencia de los aa esenciales o los ácidos grasos esenciales, se requieren en cantidades mínimas.Su falta provoca avitaminosis o hipovitaminosis, que produce enfermedades carenciales. El exceso, sobre todo de las liposolubles, provocar hipervitaminosis, que ocasiona efectos secundarios.Las vitaminas se clasifican en liposolubles e hidrosolubles.
 Los ácidos nucleicos son biomoléculas fibrilares gigantes, no ramificadas, que contienen la información genética. Esta información codificada permite llevar a cabo el metabolismo y los ciclos biológicos. Contienen la propia información en forma de genes y también las instrucciones para leerla.Son biopolímeros formados por monómeros llamados nucleótidos.
Los ácidos nucleicos son biomoléculas fibrilares gigantes, no ramificadas, que contienen la información genética. Esta información codificada permite llevar a cabo el metabolismo y los ciclos biológicos. Contienen la propia información en forma de genes y también las instrucciones para leerla.Son biopolímeros formados por monómeros llamados nucleótidos.
 Biomoléculas de elevado peso molecular formadas por combinación de unos 20 monómeros diferentes llamados aminoácidos.Son la biomoléculas más abundantes en los seres vivos, las más variadas y las de mayor número de funciones.
Biomoléculas de elevado peso molecular formadas por combinación de unos 20 monómeros diferentes llamados aminoácidos.Son la biomoléculas más abundantes en los seres vivos, las más variadas y las de mayor número de funciones.1.1 Aminoácidos proteicos.
Existen 20 aa diferentes, los aa proteicos, están formados por un carbono central (Cα) que se une a un grupo amino (-NH2), un grupo ácido (-COOH), un hidrógeno (-H) y una cadena lateral (R) variable.
De los 20 aa, los humanos sólo sintetizan 12 en adultos y 10 en la infancia, el resto ha de tomarse con la dieta, los llamados aa esenciales.
Son anfóteros, actúan como ácidos y como bases. En disolución, el grupo amino y el ácido están ionizados, formas zwitteriónicas.
Algunos aa o derivados intervienen en la comunicación celular, como neurotransmisores o como hormonas.
Se clasifican según la polaridad de las cadenas R laterales:
-Apolares: cadena R con grupos hidrófobos que se unen a otros por fuerzas de Van der Waals. Pueden ser alifáticos u aromáticos.
-Polares sin carga: R con grupos polares que pueden formar puentes de H.
-Polares con carga ácidos: R tiene grupos carboxilo.
-Polares con carga básicos: R tiene grupos amino.
1.2. Niveles de organización de las proteínas.
La funcionalidad de las proteínas depende de su estructura tridimensional o espacial, la cual presenta cuatro niveles de organización:
-Estructura primaria: Es la formada por la secuencia de aa. Los aa se unen por enlace peptídico, unión entre el amino de un aa y el carboxilo de otro, con pérdida de H2O. Se forma así un péptido.
Toda cadena peptídica tiene un extremo amino (N-terminal) y otro carboxilo (C-terminal). La estructura primaria viene así definida por el número, tipo y secuencia de los aa.
Las cadenas peptídicas pueden rotar alrededor de los enlaces C-Cα y N-Cα, pero no alrededor del enlace peptídico, que tiene carácter de doble enlace. Por ello, los átomos del enlace peptídico están en un mismo plano y le da a la cadena un aspecto de placas planas articuladas.
-Estructura secundaria: A medida que la cadena polipeptídica se sintetiza en los ribosomas, se va plegando para adquirir la estructura tridimensional más estable. Es este plegamiento intervienen proteínas llamadas chaperonas. La estructura secundaria es la conformación espacial de la cadena polipeptídica, unida por puentes de H entre los grupos –C=O de unos enlaces peptídicos y los –NH de otros enlaces. Puede tomar una forma irregular.
- Conformación α-hélice: la sucesión de aa de la estructura primaria se enrolla sobre sí misma en forma de hélice.
- Hélice de colágeno: consiste en tres hélices levógiras enrolladas entre sí.
- Conformación β-laminar: La cadena polipeptídica queda extendida y se pliega sobre sí misma, con fragmentos paralelos y antiparalelos enfrentados y unidos por puentes de H. Queda una lámina plegada en zigzag,
-Estructura terciaria: estructura espacial definitiva de la proteína con regiones en α-hélice y β-laminar mezcladas. Como resultado se obtienen proteínas fibrosas o filamentosas con estructura simple, alargada, resistente e insoluble y proteínas globulares, esferoidales, compactas y solubles.
-Estructura cuaternaria: consiste en la asociación de varias cadenas polipeptídicas para formar una proteína compleja. La unión entre cadenas se da por enlaces débiles: puentes de H, fuerzas electrostáticas, fuerzas de Van der Waals y, en algunos casos, puentes disulfuro.
Es responsable de su actividad biológica. Dado que, en última instancia, toda estructura depende de la secuencia de aa, cualquier cambio en esta puede afectar a la funcionalidad.
- Alosterismo: algunas proteínas presentan dos tipos de estructura espacial, un estado activo y otro inactivo. Las proteínas alostéricas presentan esos estados, pero gracias a la unión con moléculas llamadas ligandos, que modifican su estructura espacial. El alosterismo es uno de los mecanismos más eficaces para regular la función de una proteína, activándola o inactivándola según las necesidades.
1.3. Propiedades de las proteínas.
Las propiedades físicas y químicas de las proteínas dependen en última instancia de la secuencia de aa.
-Especifidad: las proteínas presentan una superficie o centro activo, formado por grupos funcionales de algunas cadenas laterales R de su superficie que les permite interaccionar con otras moléculas. El resto de la proteína tiene como función mantener la forma apropiada para que la superficie activa esté en posición correcta.
La actividad biológica de las proteínas se basa en la unión selectiva del centro activo con moléculas que encajan perfectamente en él.
Esta característica de unión selectiva se llama especificidad y depende de la secuencia de aa.
-Solubilidad: las proteínas globulares son solubles debido a sus cargas, que atraen al agua, formando una capa de solvatación.
-Desnaturalización: es la pérdida de la conformación espacial, que conlleva la pérdida de funcionalidad. Se produce en condiciones desfavorables. Las proteínas se convierten en filamentos fibrosos insolubles.Si las condiciones desfavorables duran poco tiempo o son poco intensas, la desnaturalización puede ser reversible y la proteína recuperar su estructura y función, en otros casos es irreversible.
1.4. Clasificación de las proteínas.
-Holoproteínas: formadas sólo por aa. Pueden ser:
- Globulares: esféricas y solubles. Se dividen en albúminas, con función de reserva y transporte y globulinas.
- Histonas y protaminas: unidas a los ácidos nucleicos.
- Fibrosas o escleroproteínas: insolubles, estructurales.
-Heteroproteínas: llevan un grupo proteico y una parte no proteica.
- Glucoproteínas: glucoconjugados. Proteínas de membrana, hormonas.
- Lipoproteínas: proteínas sanguíneas que transportan triglicéridos, colesterol y otros lípidos.
- Cromoproteínas: el grupo prostético es una sustancia coloreada. Puede ser de naturaleza porfirínica o no porfirínica.
- Otras heteroproteínas: fosfoproteínas y nucleoproteínas.
1.5. Funciones de las proteínas.
-Reserva: no suelen ser combustibles. Ovoalbúmina, caseína.
-Estructural: una función típica. Glucoproteínas, huso acromático y citoesqueleto, histonas, colágeno.
-Homeostática: actúan como tampones o sistemas buffer, regulando el pH.
-Portadoras de mensajes: hormonas, neurotransmisores: endorfinas y encefalinas.
-Recepción y transmisión de señales: actúan como receptores de membrana. Se unen a una molécula portadora de un mensaje y sufren un cambio conformacional que es una señal para provocar una respuesta. Las señales pasan de las membranas al citoplasma por un sistema de transducción de señales mediante proteínas alostéricas que sufren activación en cascada.
-Transporte: transporte a través de membranas, oxígeno, electrones, lípidos, fármacos y tóxicos.
Destacan las lipoproteínas plasmáticas, que transportan lípidos en sangre:
- Quilomicrones: transportan triacilglicéridos y colesterol de la dieta, desde intestino a hígado.
- VLDL y LDL: transportan triacilglicéridos y colesterol sintetizados desde el hígado a los tejidos.
- HDL: transportan colesterol desde tejidos al hígado.
-Defensa: coagulación, germicidas, anticuerpos.
-Contráctil: son los motores moleculares, proteínas que se desplazan unidireccionalmente por el citoesqueleto. Transportan orgánulos, vesículas; mueven a las células.
-Enzimática: quizá la más importante. Las más numerosas y especializadas. Son biocatalizadores del metabolismo. Son específicas de las reacciones y sustratos que catalizan. La vida depende de la actividad catalítica, que acelera las reacciones químicas.
2. Enzimas biocatalizadoras.
Las enzimas son biocatalizadores del metabolismo. Intervienen en concentraciones muy pequeñas, aceleran las reacciones y no sufren modificaciones. La mayoría son proteínas, por lo que ejercen su función mediante unión selectiva a sustancias denominadas sustratos.
La unión enzima-sustrato produce cambios químicos en los sustratos, que se transforman en productos.
2.1. Actuación de las enzimas.
Las enzimas son las responsables del metabolismo, reacciones que permiten a los seres vivos obtener energía y materia para sus funciones. Los sustratos se transforman en productos mediante rutas metabólicas catabólicas y anabólicas.
Para que un sustrato se convierta en producto, necesita una cierta cantidad de energía. El sustrato ha de alcanzar un estado llamado estado de transición o estado activado. La energía necesaria para alcanzar este estado se denomina energía de activación. Las enzimas, como todos los catalizadores, aceleran las reacciones disminuyendo la energía de activación.
2.2. Cofactores: coenzimas y vitaminas.
Algunas enzimas, llamadas holoenzimas no poseen la estructura necesaria para realizar su función. Para conseguirla han de unirse a otras moléculas no proteicas, los cofactores. El cofactor puede ser:
- Orgánico o metaloorgánico: unido por enlaces débiles como las coenzimas o por enlaces covalentes como los grupos prostéticos.
- Iónico: iones minerales como Mg, Zn, Cu… moldean la enzima para darle la forma adecuada.
 -Vitaminas: Son sustancias de naturaleza variable, imprescindibles para el metabolismo pero no sintetizables, deben tomarse en la dieta.Las vitaminas, a diferencia de los aa esenciales o los ácidos grasos esenciales, se requieren en cantidades mínimas.Su falta provoca avitaminosis o hipovitaminosis, que produce enfermedades carenciales. El exceso, sobre todo de las liposolubles, provocar hipervitaminosis, que ocasiona efectos secundarios.Las vitaminas se clasifican en liposolubles e hidrosolubles.
-Vitaminas: Son sustancias de naturaleza variable, imprescindibles para el metabolismo pero no sintetizables, deben tomarse en la dieta.Las vitaminas, a diferencia de los aa esenciales o los ácidos grasos esenciales, se requieren en cantidades mínimas.Su falta provoca avitaminosis o hipovitaminosis, que produce enfermedades carenciales. El exceso, sobre todo de las liposolubles, provocar hipervitaminosis, que ocasiona efectos secundarios.Las vitaminas se clasifican en liposolubles e hidrosolubles.
2.3. Especifidad enzimática.
Las enzimas son altamente específicas de las reacciones que catalizan y de los sustratos sobre los que actúan, pues poseen en su superficie una zona activa denominada centro catalítico a la que se adapta el sustrato.El centro catalítico tiene una estructura apropiada para el sustrato, pero no es totalmente rígido, sigue el modelo de acoplamiento inducido, el propio sustrato modifica el centro catalítico para que ambos se acoplen.
2.4 Cinética enzimática.
La cinética enzimática estudia la velocidad de actuación de las enzimas, medida en unidades de sustrato transformado o unidades de producto obtenidas por unidad de tiempo.
2.5. Inhibición enzimática.
Ciertas sustancias disminuyen o anulan la velocidad enzimática, son los inhibidores. Estos pueden ser:
-Reversibles: la unión con el inhibidor es temporal. Hay tres tipos:
- Competitiva: el inhibidor es similar en estructura al sustrato, por lo que compite con él por unirse al centro activo.
- No competitiva: el inhibidor se une en un lugar diferente del centro activo y lo modifica, impidiendo la unión del sustrato.
- Acompetitiva: el inhibidor se une al complejo E-S, impidiendo que se forme el producto.
-Irreversible: la unión del inhibidor es permanente.
2.6, Factores que modulan la actividad enzimática.
-Variaciones de temperatura: el aumento de la temperatura altera la estructura tridimensional de la enzima. Existe una temperatura óptima a la que la actividad enzimática es máxima. La bajada de temperatura reduce la actividad, pero no la desnaturaliza.
-Cambios de pH: las variaciones de pH ocasionan alteración de cargas y cambios conformacionales. Existe igualmente un pH óptimo, diferente para cada enzima.
-Alosterismo: las enzimas alostéricas presentan una forma activa y otra inactiva, en función de la unión a ligandos en los centros reguladores de la enzima.
2.7. Nomenclatura y clasificación.
Las enzimas suelen nombrarse con un prefijo que indica el sustrato sobre el que actúan o la reacción que catalizan seguido del sufijo –asa.
3. Ácidos nucleicos.
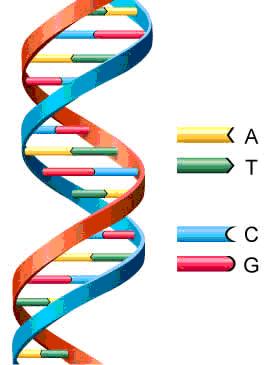
 Los ácidos nucleicos son biomoléculas fibrilares gigantes, no ramificadas, que contienen la información genética. Esta información codificada permite llevar a cabo el metabolismo y los ciclos biológicos. Contienen la propia información en forma de genes y también las instrucciones para leerla.Son biopolímeros formados por monómeros llamados nucleótidos.
Los ácidos nucleicos son biomoléculas fibrilares gigantes, no ramificadas, que contienen la información genética. Esta información codificada permite llevar a cabo el metabolismo y los ciclos biológicos. Contienen la propia información en forma de genes y también las instrucciones para leerla.Son biopolímeros formados por monómeros llamados nucleótidos.
Los nucleótidos, a su vez, son moléculas complejas, formadas por 3 componentes:
-Una molécula de ácido fosfórico (grupo fosfato).
-Un azúcar (pentosa) ciclada. Puede ser:
- β-D-ribosa, en el ARN.
- β-D-desoxirribosa, en el ADN.
-Una base nitrogenada. Hay dos tipos:
- Púricas: derivadas de la purina. Estructura con doble anillo.
- Pirimidínicas: derivadas de la pirimidina. Con un único anillo.
3.1. Nucleósidos.
Los nucleósidos resultan de la unión de la pentosa y una base nitrogenada. Existen 2 tipos de nucleósidos, cada uno con cuatro de las cinco bases posibles:
-Ribonucleósidos: contienen ribosa unida a A, G, C o U.
-Desoxirribonucleósidos: contienen desoxirribosa unida a A, G, C o T.
3.2. Nucleótidos.
Los nucleótidos resultan de la unión, mediante enlace éster, de un grupo fosfato al C5’ de la pentosa del nucleósido. Un nucleótido es un nucleósido fosforilado en posición 5’.
-Tipos de nucleótidos y funciones que desempeñan.
Los nucleótidos pueden presentarse libres o unidos a otras moléculas. El grupo fosfato puede unirse a otros grupos, dando entre otros:
- Enlaces “ricos en energía” con otros grupos fosfato: nucleótidos difosfato y trifosfato (ADP, ATP). Transportan energía en sus enlaces, fácilmente hidrolizables.
- Un enlace éster intramolecular con el –OH en posición 3’, formando el AMP cíclico (AMPc): que actúa como segundo mensajero entre moléculas extracelulares e intracelulares.
- Unión al grupo fosfato de otro nucleótido o de otra molécula, formando nucleótidos no nucleicos, que actúan como coenzimas. Coenzima A, FAD y NAD+.
- Otro enlace éster con el –OH en posición 3’ de otro nucleótido, que se une a otro y así sucesivamente, dando cadenas de nucleótidos: ácidos nucleicos.
3.3. Ácido desoxirribonucleico (ADN).
Biopolímero lineal de desoxirribonucleótidos-5’-monofosfato de A, G, C y T.

-Estructura primaria: es la secuencia de desoxirribonucleótidos-5’-monofosfato. La cadena transcurre en dirección 5’ 3’. El grupo fosfato forma un puente fosfodiéster entre dos desoxirribosas.
Cada polinucleótido tiene dos partes:
- Un esqueleto de polidesoxirribosa-fosfato, común para todos los ADN.
- La secuencia de bases nitrogenadas que diferencia unos ADN de otros.
Cada molécula de ADN se diferencia en el número, tipo y secuencia de sus bases nitrogenadas. Esta secuencia contiene la información para la síntesis de proteínas.
-Estructura secundaria: es una doble hélice, formada por dos cadenas polinucleotídicas, enrolladas entre sí, enfrentadas por sus bases y unidas por puentes de H.El conjunto recuerda a una escalera de caracol, con el esqueleto de ribosa-fosfatos como pasamanos y las bases nitrogenadas como los peldaños de la escalera.
-La desnaturalización del ADN es la separación de las dos cadenas por rotura de los puentes de H, sin que se afecten los enlaces éster de cada cadena. Se produce por aumento de la temperatura, variación de pH o cambios iónicos. La desnaturalización por temperatura se denomina fusión. Se llama punto de fusión a la temperatura en que la mitad de las moléculas de ADN están desnaturalizadas.
La desnaturalización es reversible. Recobradas las condiciones necesarias, si dos cadenas son total o parcialmente complementarias, volverán a unirse.
3.4. Otros niveles de complejidad del ADN.
En procariotas, el ADN, que es una doble cadena circular, se une a unas pocas proteínas y se enrolla en una superhélice en forma de ochos.
En eucariotas el problema es mayor, ya que hay numerosas cadenas de ADN y mucha mayor cantidad. Para plegarse, se une a un gran número de proteínas llamadas histonas. La forma compacta así adquirida se denomina cromatina, que es una estructura muy compleja y ordenada. Durante la división celular, la cromatina se empaqueta aún más, formando los cromosomas.
3.5. Ácido ribonucleico (ARN).
Biopolímero lineal de ribonucleótidos-5’-monofosfato. Su estructura primaria es idéntica a la del ADN. Sin embargo, ARN y ADN presentan las siguientes diferencias:
3.4. Otros niveles de complejidad del ADN.
En procariotas, el ADN, que es una doble cadena circular, se une a unas pocas proteínas y se enrolla en una superhélice en forma de ochos.
En eucariotas el problema es mayor, ya que hay numerosas cadenas de ADN y mucha mayor cantidad. Para plegarse, se une a un gran número de proteínas llamadas histonas. La forma compacta así adquirida se denomina cromatina, que es una estructura muy compleja y ordenada. Durante la división celular, la cromatina se empaqueta aún más, formando los cromosomas.
3.5. Ácido ribonucleico (ARN).
Biopolímero lineal de ribonucleótidos-5’-monofosfato. Su estructura primaria es idéntica a la del ADN. Sin embargo, ARN y ADN presentan las siguientes diferencias:
- El ARN lleva ribosa y el ADN, desoxirribosa. La presencia del grupo –OH libre en los ribonucleótidos crea tensiones que hacen del ARN una molécula menos estable que el ADN.
- El ARN lleva la base U, en lugar de T, frente a la A.
- El ARN suele tener sólo estructura primaria.
- El ARN constituye el genoma de ciertos virus. Algunos ARN tienen actividad catalítica, es decir, son enzimas llamados ribozimas.
- Para clasificar los ARN suele usarse su masa molecular Se mide de forma indirecta mediante el coeficiente de sedimentación.
-ARN mensajero (ARNm).
Es una larga cadena polinucleotídica, de longitud variable, con estructura primaria. Filamento que lleva información para sintetizar una cadena polipeptídica.
El ARNm es diferente en procariotas y eucariotas:
- Procariotas: poseen en el extremo 5’ un grupo trifosfato.
- Eucariotas: en el extremo 5’ llevan una especie de caperuza consistente en metil guanosina unida a un trifosfato. En el extremo 3’ llevan una cola llamada cola de poli A por estar formada por unos 150-200 nucleótidos de A.
-ARN nucleolar (ARNn).
ARN de elevado peso molecular, con estructura terciaria en algunas regiones. Se sintetiza en el nucleolo y es un precursor de diferentes ARNr, que formarán las subunidades del ribosoma.
-ARN ribosómico (ARNr).
Moléculas de tamaño variable, con estructura 2ria y 3ria en algunas regiones. Se unen a más de 60 proteínas para formar los ribosomas.
Los diferentes ARNr le dan a los ribosomas la estructura apropiada para albergar al ARNm y a los aa unidos a ARNt para la síntesis de proteínas.
-ARN de transferencia (ARNt).
Moléculas pequeñas, con estructura 2ria y 3ria, que llevan los aa hasta los ribosomas para la síntesis proteica. La estructura 2ria del ARNt consta de:
- Un brazo aceptor: formado por el extremo 5’ (G-P) y el 3’ con la secuencia CCA cuyo –OH terminal servirá de unión al aa correspondiente.
- Un bucle o brazo TψC: lugar de reconocimiento del ribosoma.
- Un bucle o brazo D: con una secuencia reconocida específicamente por una de las 20 enzimas aminoacil-ARNt sintetasas, que unen cada aa a su ARNt correspondiente.
- El brazo anticodón, un bucle situado en el extremo del brazo largo. Contiene una secuencia de 3 bases llamada anticodón, que se une específicamente a tripletes complementarias del ARNm que se lee en el ribosoma.
3.6. Funciones biológicas de los ácidos nucleicos.
-Replicación: el ADN se replica o duplica, haciendo copias de sí mismo. Se libera de las histonas, se abre separando las dos cadenas y se sintetiza la complementaria de cada una. Así se forman dos copias idénticas para repartir a las células hijas en la división celular, pasando la información genética de generación en generación.
-Almacenamiento de la información genética: contiene, en lenguaje químico la información necesaria para sintetizar todas las proteínas de un organismo.
-Transcripción: la información del ADN se transcribe al ARNm, gracias a la complementariedad de bases A=U y G≡C.
-Traducción: el mensaje del ADN se convierte en proteínas. Los ribosomas leen el ARNm y fabrican una proteína con ayuda del ARNt que aporta los aa.
Fuente: biologeo.


Comentarios
Publicar un comentario
Gracias por comentar. Te rogamos que seas preciso y educado en tus comentarios.